Recientemente, tuve el honor de participar como ponente en la conferencia anual de la Sociedad Mexicana de Ingenieros Biomédicos (SOMIB) celebrada en Villahermosa, Tabasco. Me complació mucho tener la oportunidad de compartir con los estudiantes mi trayectoria de toda una vida en la industria de dispositivos médicos y, en particular, mis experiencias en el espacio emprendedor. Agradezco al presidente de la SOMIB, Maestro Francisco Aceves, por la invitación y por el esfuerzo de él y su equipo en organizar un evento tan agradable.
A pesar de la asistencia modesta de estudiantes y profesores interesados en lo que tenía que decir sobre el emprendimiento en dispositivos médicos, no creo ser el único en decir que el Emprendimiento en Dispositivos Médicos en México todavía se encuentra en pañales. A pesar de los esfuerzos individuales como los de los amigos y colegas Ramsés Galaz (GSE Biomedical), Andrea Siller (Bioana) y Benjamín Morales (Machina Labs), personas que realmente se esfuerzan por la excelencia en la ejecución de proyectos, debemos hacer más. No es aceptable simplemente decir, “no somos Estados Unidos”, sino buscar formas de acelerar nuestro crecimiento y emular a dicho líder global.
Quizás ustedes tengan ideas claras sobre lo que se necesita hacer, pero para otros que creen que ya están haciendo todo lo que pueden, aquí hay algunas:
Estudiantes: Los estudiantes de Ingeniería Biomédica (IB) tienen el potencial de ser el puente entre los mundos científico y médico y la comercialización exitosa de productos innovadores. Entiendo que su enfoque actual de tener una carrera basada en la recomendación, instalación y mantenimiento de equipos médicos en el entorno clínico es su mejor oportunidad de empleo en el futuro, pero los reto a explorar el emprendimiento de dispositivos médicos. Comiencen identificando una enfermedad que les resulte significativa y profundicen en su conocimiento sobre la misma. Encuentren médicos locales que traten dichas enfermedades y entrevisten a uno, dos, veinte o más, y comprendan sus desafíos diarios. Ahí encontrarán una necesidad clínica no satisfecha. Como algunos de ustedes ahora saben, la identificación de una gran necesidad clínica no satisfecha es el paso más importante en su camino para convertirse en emprendedores.
Universidades: Encuentren una forma de introducir el desarrollo de dispositivos médicos y el emprendimiento en su currículo de IB. Colaboren con la industria, tanto a nivel nacional como internacional, para desarrollar programas de pasantías de pregrado, para entender las mayores necesidades de mercado. Incentiven a sus profesores e investigadores con la capacidad de buscar soluciones innovadoras.
Oficinas de Transferencia Tecnológica: Sean juiciosos en lo que patentan. Solo porque algo puede ser patentado no significa que deba serlo. No sirve de nada tener una amplia cartera de propiedad intelectual (PI) que no genera interés para ser licenciada. En lugar de financiar muchas patentes inútiles, busquen identificar aquellas que tienen el potencial de tener un impacto significativo y asegúrense de no descuidar el pago de mantenimiento de esa PI. Hagan su mejor esfuerzo para seleccionar carteras que puedan tener un potencial global. Por último, comercialicen estas carteras de Tecnología agresivamente.
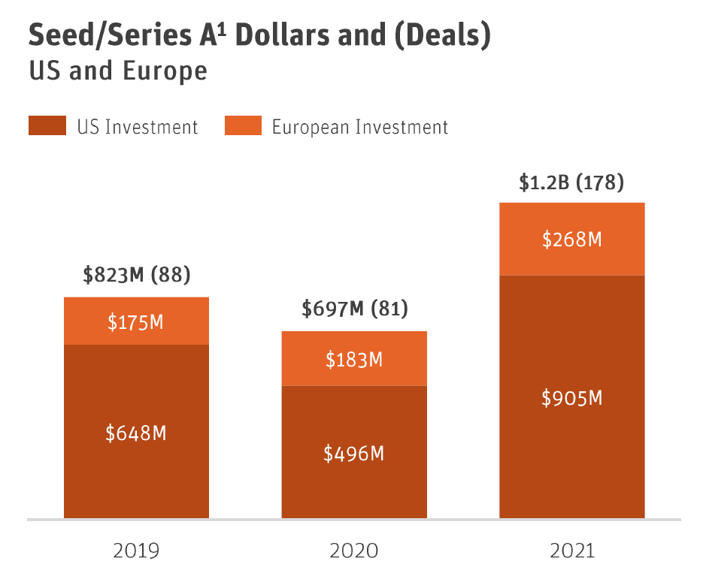
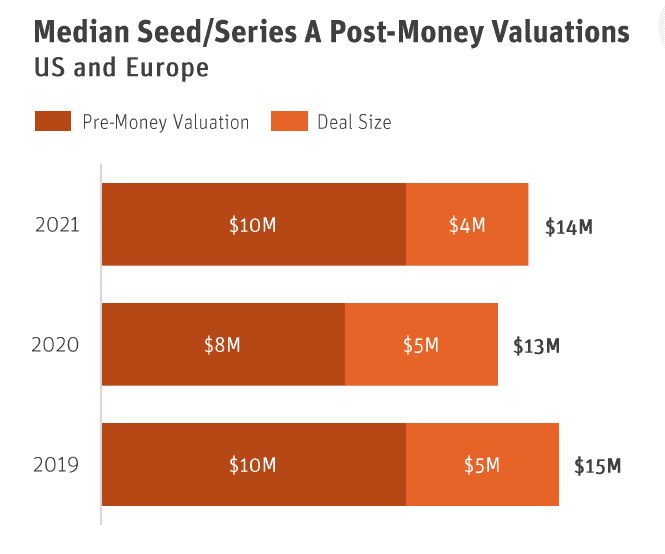
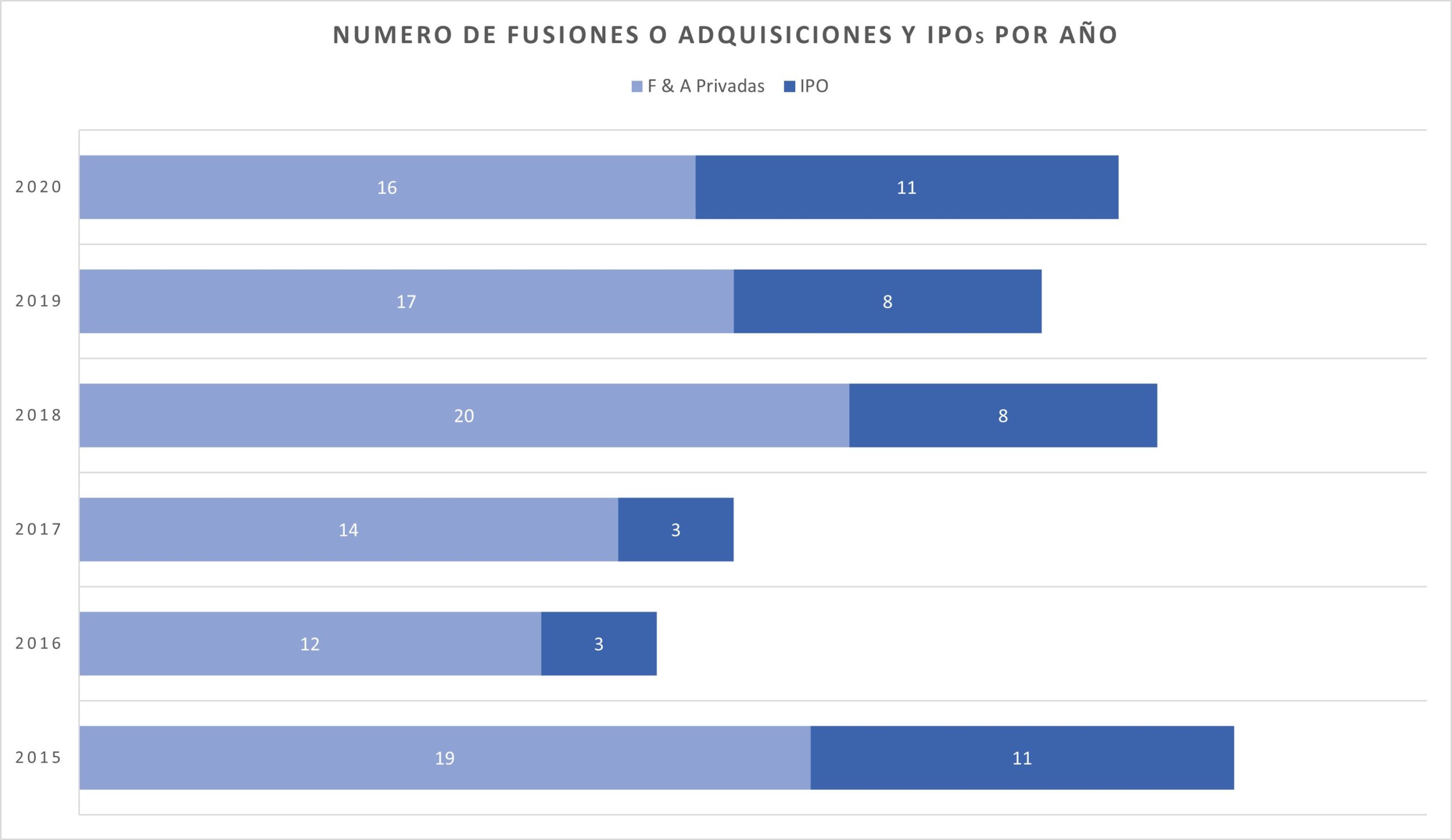
Inversionistas: Por favor, entiendan que el modelo de capital de riesgo no se trata de cuándo un startup logrará la primera venta de su producto, sino de una salida exitosa de la compañía, ya sea a través de una fusión y adquisición (M&A) o una oferta pública inicial (IPO). Solo entonces deberían esperar un retorno de su inversión. Debido a que hay escasa financiación para este sector, solo consideren financiar startups que tengan el potencial de recaudar fondos con éxito en EE. UU. Esto asegurará que las ideas y los equipos débiles no consuman la limitada financiación que está disponible. Aunque esto pueda parecer contraproducente para ayudar a nuestra industria local, recordemos que más de $1.2 mil millones de dólares se invirtieron en startups de EE. UU./UE en el 2021, con la industria realizando más de $27 mil millones de dólares en salidas.
Industria: Es esencial que las empresas organicen simposios para comunicar a las universidades sus intereses específicos y necesidades de investigación, ya sea de manera específica o a través de la colaboración con organizaciones como la Red Mexicana de Oficinas de Transferencia de Tecnología. Crear un programa de pasantías donde los estudiantes puedan obtener una comprensión del desarrollo de productos, Asuntos Regulatorios y Clínicos, Aseguramiento de la Calidad y Gestión de la Calidad de Proveedores, entre otros. Apoyen a su asociación profesional local, la SOMIB y envíen un equipo a la conferencia nacional, tanto para promocionar su empresa como para encontrar talento de primer nivel.
Proveedores de Atención Médica: Organicen foros para captar ideas de sus médicos y enfermero/as. Trabajen con su universidad local para comunicar sus desafíos y asesorar a los empresarios potenciales sobre la importancia de resolver estos problemas.
Gobierno: Encuentren una forma de invertir más en investigación básica, pero háganlo con un ojo agudo hacia las necesidades clínicas más importantes. Busquen formas de patrocinar a los estudiantes para estudiar en el extranjero durante un semestre y asegúrense de que haya un incentivo para traer a casa conocimientos y mejores prácticas.
A principios de los años 2000, China, Irlanda, México y Costa Rica tenían clústeres de MedTech predominantemente orientados a la exportación (Torsekar, 2019, Three Key Takeaways from Four International Medtech Clusters). En el transcurso de la última década, China e Irlanda han podido especializarse en actividades de alto valor agregado como I+D y Marketing. México y Costa Rica siguen participando en elementos de bajo valor agregado en la cadena de valor.
Es tiempo de expandirse más allá de la fabricación de dispositivos médicos para filiales de EE. UU. y sentar las bases para el crecimiento y la expansión de empresas originadas en México.
Fijemos nuestra mirada en la planificación del CNIB 2024 a celebrarse en Hermosillo, Sonora. Esto será un desafío para mi amigo y colega, Elliot Vernet, en pensar audazmente y ofrecer a nuestros futuros empresarios, el mejor congreso que SOMIB haya organizado jamás.